-
Aufgabe 1
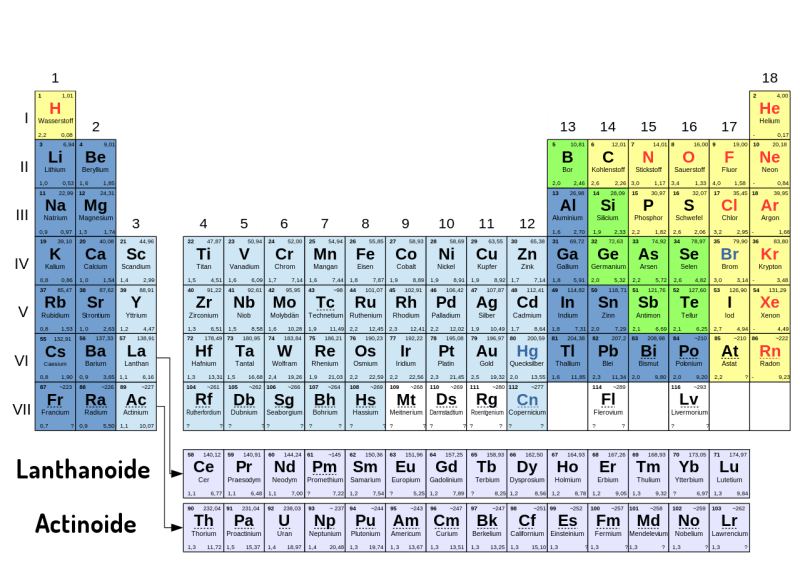
Dauer: 6 Minuten 8 PunkteGegeben ist das Periodensystem der Elemente.
- Wo im Periodensystem findet man die Metalle, wo die Nichtmetalle?
- Welches der folgenden Elemente ist ein Metall? Bitte ankreuzen:
Natrium \(\Box\) Brom \(\Box\) Calcium \(\Box\) Schwefel \(\Box\) Fluor \(\Box\) Nickel \(\Box\) Radon \(\Box\) Tantal \(\Box\) Bor \(\Box\) Silicium \(\Box\) Quecksilber \(\Box\) Blei \(\Box\)
-
Aufgabe 2
Dauer: 4 Minuten 3 PunkteNenne drei typische Materialeigenschaften von Metallen.
1.___________________ 2.___________________ 3.___________________ -
Aufgabe 3
Dauer: 10 Minuten 12 PunkteWelchen dieser Gegenstände würdest du aus einem Metall herstellen, welchen nicht? Begründe, warum.
- Kochtopf:
- Bettdecke:
- Spiegel:
- Elektrokabel:
- Bremsflüssigkeit:
- Heftklammern zum Tackern:
-
Aufgabe 4
Dauer: 5 Minuten 5 PunkteManche Metalle sind reaktiver und damit weniger edel als andere. Ordne die folgenden Metalle nach steigender Reaktivität:
Gold Cäsium Eisen Zinn Kupfer __________ __________ __________ __________ __________ -
Aufgabe 5
Dauer: 5 Minuten 2 PunkteWas unterscheidet Metalle von Nichtmetallen, außer der Lage im Periodensystem? Verwende in deiner Erklärung die Begriffe „Atom“, „Valenzelektronen“ und „Ionen“.
-
Aufgabe 6
Dauer: 4 Minuten 5 PunkteErgänze folgenden Lückentext mit den richtigen Begriffen aus der am Ende gegebenen Liste. Die Begriffe können auch gar nicht oder mehrfach verwendet werden.
Wenn Metalle mit anderen Elementen reagieren, dann sind sie stets bestrebt, ihre ______________ abzugeben. Dabei entsteht ein ______________. Ist der Reaktionspartner ein ______________, dann bildet dieses durch die Aufnahme der ______________ ein ______________, welches mit dem Metall-______________ ein ______________ bildet. Darin ziehen sich ______________ und ______________ ______________ an.
Auswahlmöglichkeiten: Anion(en) / Kation(en) / Halbmetall / Valenzelektron(en) / freie Elektronenpaare / Ionengitter / Metallgitter / Nichtmetall / Metall / Proton(en) / Atom(e) / elektrostatisch / magnetisch / negativ / positiv
-
Aufgabe 7
Dauer: 5 Minuten 4 PunkteWenn Sauerstoff mit Magnesium reagiert, entsteht Magnesiumoxid, dessen Summenformel MgO ist. Wenn Chlor mit Magnesium reagiert, entsteht MgCl2. Erkläre, warum Magnesium mit nur einem Sauerstoffatom reagiert, während es bei Chlor zwei sind.
-
Aufgabe 8
Dauer: 5 Minuten 8 PunkteTypisch ist die Reaktion einer Säure mit einem (unedlen) Metall.
- Nenne das allgemeine Schema der Reaktion einer Säure mit einem Metall:
Säure + Metall \(\longrightarrow\) ____________ + ____________ - Nenne die Wortgleichung und die Formelgleichung für die Reaktion von Calcium mit Salzsäure:
Salzsäure + Calcium \(\longrightarrow\) ____________ + ____________ ____________ + ____________ \(\longrightarrow\) ____________ + ____________
-
Aufgabe 9
Dauer: 11 Minuten 13 PunkteDrei wichtige Metalle sind Eisen, Gold und Aluminium.
- Ordne diese drei Metalle nach steigender Reaktivität:
__________________ __________________ __________________ -----------------------------------------------------------------► steigende Reaktivität - Welches dieser Metalle wurde in der Menschheitsgeschichte als Erstes genutzt, welches als Letztes?
__________________ __________________ __________________ -----------------------------------------------------------------► späteste Nutzung - Nenne die Herstellungs- bzw. Gewinnungsmethode für jedes dieser drei Metalle:
Gold: Eisen: Aluminium: - Erkläre, warum die Antwort zu Teilaufgabe b sich durch die Antwort auf Teilaufgabe c begründen lässt und inwieweit das mit der Fragestellung aus Teilaufgabe a zusammenhängt.
-
Aufgabe 1
Gegeben ist das Periodensystem der Elemente.
- Wo im Periodensystem findet man die Metalle, wo die Nichtmetalle?
- Welches der folgenden Elemente ist ein Metall? Bitte ankreuzen:
Natrium \(\Box\) Brom \(\Box\) Calcium \(\Box\) Schwefel \(\Box\) Fluor \(\Box\) Nickel \(\Box\) Radon \(\Box\) Tantal \(\Box\) Bor \(\Box\) Silicium \(\Box\) Quecksilber \(\Box\) Blei \(\Box\)