Röntgenstrahlen sind kurzwellige, d. h. energiereiche elektromagnetische Wellen, die im Spektrum zwischen der UV-Strahlung und der Gammastrahlung liegen.
Röntgenstrahlung ist unsichtbar, erzeugt Fluoreszenz, hat starke chemische Wirkung (z. B. Schwärzung von Fotoplatten) und hohes Ionisationsvermögen. Sie zeigt wie das Licht Reflexion, Brechung, Beugung, Interferenz und Polarisation. Der Hauptunterschied zum Licht ist das hohe Durchdringungsvermögen für die meisten Stoffe, das den sprichwörtlichen „Röntgenblick“ sowie zahlreiche Anwendungen in der medizinischen Diagnostik ermöglicht.
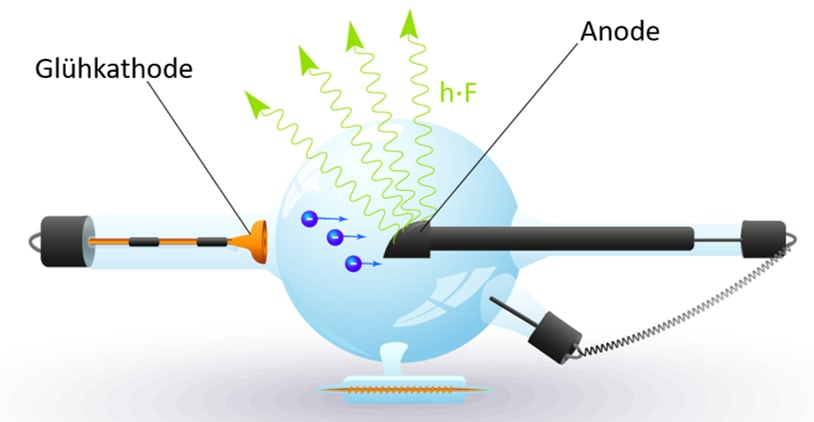
Die Erzeugung von Röntgenstrahlen erfolgt auch heute noch in der Regel mit einer speziellen Elektronenröhre, der Röntgenröhre. ln dieser beschleunigt eine elektrische Spannung U im Bereich von Kilovolt Elektronen, die dann mit entsprechend hoher Energie auf eine Anode aus einem geeigneten Material treffen und dort Röntgenstrahlung auslösen (Abb.).
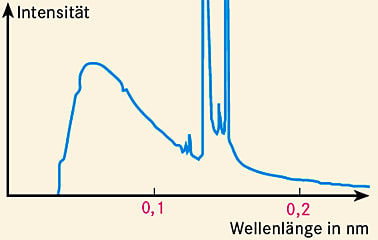
Ein typisches Röntgenspektrum (Abb. unten) zeigt, dass zwei Prozesse zur Röntgenemission führen:
- Die Röntgenbremsstrahlung entsteht durch die Abbremsung schneller Elektronen im Anodenamterial. Wie jede beschleunigte Ladung sendet auch ein abgebremstes Elektron elektromagnetische Wellen aus (Bremsstrahlung). Für deren Frequenz f gilt \(\Delta E = h \cdot f\)(\(\Delta E\): Energieverlust, h: Planck’sches Wirkungsquantum). Da ganz verschiedene Energieverluste möglich sind, erhält man ein kontinuierliches Spektrum. Die maximal mögliche Grenzfrequenz ergibt sich aus der maximal zur Verfügung stehenden kinetischen Energie der Elektronen:
\(f_\text{max} = \dfrac {e \cdot U} h\)
(e: Elementarladung, U: Beschleunigungsspannung). Entsprechend weist das Bremsspektrum eine kürzeste Wellenlänge \(\lambda_\text{min} = \dfrac c {f_\text{max} } \) auf. - Charakteristische Röntgenstrahlung entsteht, wenn ein schnelles Elektron (oder ein anderes energiereiches Teilchen) ein Hüllenelektron aus einem Atom schlägt und der freie Platz mit einem Hüllenelektron aus einer weiter außen liegenden Schale wieder aufgefüllt wird. Dabei wird ein Photon emittiert, dessen Energie der Energiedifferenz zwischen den beteiligten Elektronenzuständen bzw. den beteiligten Schalen entspricht. die für jede Atomsorte andere Werte annimmt. Der einzige Unterschied zu den Spektrallinien von optischen Spektren besteht in den erheblich kürzeren Wellenlängen, die durch die viel größere Bindungsenergie der inneren Elektronen bedingt sind.