Einordnung der chemischen Elemente, insbesondere der Metalle, nach der Größe der Potenzialdifferenz, die sich an der Phasengrenze bei jedem dieser Elemente ergibt, wenn sie in einen Elektrolyten eintauchen. Dieses elektrolytische Potenzial kann man nicht direkt messen, sondern nur relativ zu einem Referenzpotenzial. Dazu misst man die Spannung eines galvanischen Elements, dessen einer Pol das einzuordnende Element und dessen anderer Pol eine Normalwasserstoffelektrode ist. Das Element taucht hierbei als Elektrode in eine Lösung, die 1 mol Ionen des Metalls pro Liter enthält. Die nun auftretende Spannung zwischen den beiden Elektroden nennt man das Normalpotenzial ε0 (Standardpotenzial) des Metalls. Die Einordnung der Normalpotenziale in eine Reihe, in der am Anfang die (unedleren) Metalle mit dem größten negativen und am Ende die (edleren) Metalle mit dem größten positiven Potenzial stehen, ergibt die elektrochemische Spannungsreihe der Metalle (ε0 gemessen bei 25 °C).
Normalpotenzial ε0 wichtiger metallischer Redoxsysteme
|
Reaktion |
ε0 |
|---|---|
|
Li ⇌ Li+ + e– |
-3,04 |
|
K ⇌ K+ + e– |
-2,92 |
|
Ca ⇌ Ca2+ + 2e– |
-2,87 |
|
Na ⇌ Na+ + e– |
-2,71 |
|
Mg ⇌ Mg2+ + 2e– |
-2,37 |
|
Al ⇌ Al3+ + 3e– |
-1,69 |
|
Mn ⇌ Mn2+ + 2e– |
-1,18 |
|
Zn ⇌ Zn2+ + 2e– |
-0,76 |
|
Cr ⇌ Cr3+ + 3e– |
-0,74 |
|
Fe ⇌ Fe2+ + 2e– |
-0,44 |
|
Ni ⇌ Ni2+ + 2e– |
-0,23 |
|
Pb ⇌ Pb2+ + 2e– |
-0,13 |
|
2 H2O + H2 ⇌ 2 H3O+ + 2e– |
0,00 |
|
Cu ⇌ Cu2+ + 2e– |
+0,34 |
|
Ag ⇌ Ag+ + e– |
+0,80 |
|
Hg ⇌ Hg2+ + 2e– |
+0,85 |
|
Pt ⇌ Pt2+ + 2e– |
+1,20 |
|
Au ⇌ Au+ + e– |
+1,50 |
Jedes Metall kann daher an die Ionen aller in der Spannungsreihe darunter stehenden Metalle Elektronen abgeben und selbst in den Ionenzustand übergehen. Beim Eintauchen eines unedleren Elements in die Lösung der Ionen eines edleren Elements werden diese entladen; das edlere Element scheidet sich als Metall ab, die Atome des unedleren Elements gehen als Ionen in Lösung. Die Elektronenaffinität der Metalle nimmt also beim Durchlaufen der Spannungsreihe nach den positiven Normalpotenzialen hin ab. Je unedler ein Metall ist, umso negativer ist sein Normalpotenzial, umso leichter wird es oxidiert, umso stärker wirkt es als Reduktionsmittel und umso heftiger reagiert es mit Säuren und Wasser unter Wasserstoffentwicklung. Die Ionen von Metallen mit positivem Normalpotenzial sind andererseits leicht reduzierbar, sie wirken als Oxidationsmittel.
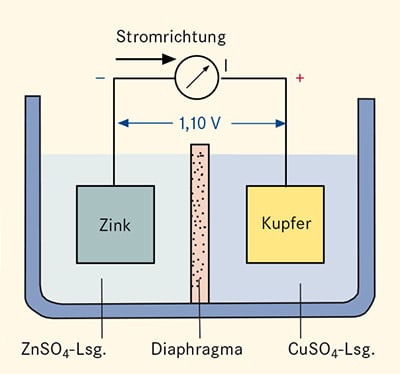
Daniell-Element
Die Differenz der Normalpotenziale zweier Metalle gibt die Spannung an, die ein mit ihnen gebildetes galvanisches Element bei gleicher Ionenkonzentration liefert, z. B. beim Daniell-Element (Kupfer-Zink-Element mit Zink- und Kupfersulfatlösung als Elektrolyt):
εCu – εZn = 0,34 – (-0,76) = 1,10 V.